ka等于1.76目录
ka等于1.76:了解其含义和影响。
ka定义。
ka一个平衡常数,表示酸解离的程度。它衡量的是酸在水中解离成离子时,形成氢离子(H)的能力。
ka等于1.76的含义。
当ka等于1.76时,表示酸的解离程度为中等。这意味着酸在水中将部分解离成离子,同时仍有相当一部分保持未解离状态。
ka值与酸性。
ka值越小,酸性越强。这是因为ka值越小,酸解离出氢离子的程度就越高。因此,ka等于1.76的酸属于中强酸。
ka值与pH值。
ka值与pH值之间存在密切关系。pH值是溶液中氢离子浓度的度量。ka值较小的酸会产生较低pH值的溶液,表明溶液中氢离子浓度较高。
ka值的应用。
ka值在化学中广泛应用,包括:。
酸性强度的测定。
缓冲溶液的配制。
滴定曲线的绘制。
化学平衡的研究。
结论。
ka等于1.76表示酸具有中等强度的解离能力。该值可用于确定酸的酸性,预测pH值,并在化学中解决各种问题。
解离常数Ka的计算
简介
解离常数Ka衡量酸在水溶液中解离成氢离子和阴离子的能力。它是一个非常重要的参数,因为它可以预测酸的强度和化学反应的平衡。
计算Ka
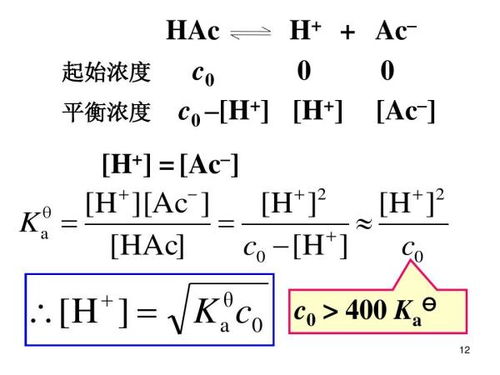
Ka通常通过实验测量酸在已知浓度下的pH值来确定。但是,它也可以使用以下公式计算:
```
Ka=[H][A-]/[HA]
```
其中:
[H]溶液中氢离子浓度
[A-]溶液中阴离子浓度
[HA]溶液中酸分子浓度
实例
例如,如果一种酸在0.1M溶液中的pH值为3,则我们可以计算其Ka值如下:
```
[H]=10^-3M
[HA]=0.1M
Ka=(10^-3M)^2/(0.1M)=10^-5
```
因此,该酸的Ka值为10^-5,表明它是一种弱酸。
影响Ka值的因素
影响酸的Ka值的因素包括:
酸的强度:较强的酸具有较大的Ka值。
溶剂:溶剂的极性会影响酸的解离度。
温度:温度的升高通常会增加Ka值。
应用
Ka值广泛应用于:
预测酸的强度:Ka值较大的酸更强。
平衡常数:Ka值可用于计算化学反应的平衡常数。
缓冲溶液:缓冲溶液使用具有特定Ka值的酸和盐来稳定溶液的pH值。
KA计算公式:深入理解和实用应用
KA计算公式介绍
KA计算公式又称酸度常数,是表征酸在水溶液中电离程度的量。该公式用于计算酸电离后产生的氢离子浓度,进而评估酸的强弱程度。
计算公式
KA计算公式如下:
```
KA=[H][A-]/[HA]
```
KA:酸度常数
[H]:氢离子浓度
[A-]:酸阴离子浓度
[HA]:未电离酸浓度
实用应用
KA计算公式在化学研究和实际应用中具有广泛的用途:
酸碱滴定:酸度常数可用于确定酸碱滴定终点的当量点。
缓冲溶液:通过控制酸度常数,可以设计缓冲溶液以维持特定的pH值。
化学反应预测:了解酸度常数有助于预测酸碱反应的方向和产物。
pH值计算:已知酸度常数和酸浓度,可以用KA计算公式计算溶液的pH值。
如何计算KA值
可以通过实验测量或从参考表中查阅获得KA值:
实验测量:使用pH计、电导仪或滴定法等方法测量溶液中氢离子浓度。
参考表:众多数据库和教科书提供各种酸的酸度常数表。
影响KA值的因素
影响KA值的因素包括:
酸的结构:电负性、共轭碱稳定性等因素会影响酸度常数。
溶剂效应:溶剂极性影响离子溶解度,从而影响KA值。
温度:温度升高一般会导致KA值增大。
结论
KA计算公式是理解酸碱化学的重要工具。它提供了酸电离程度的量化指标,并广泛应用于各种化学研究和实际应用中。通过充分理解该公式,可以深入掌握酸碱反应的本质和预测化学行为。

苯酚的ka是多少?
苯酚,又称羟基苯,是一种芳香化合物,广泛应用于工业和医药领域。其化学式为C?H?OH,由苯环和一个羟基官能团组成。
苯酚的酸性
苯酚是一种弱酸,其酸性比醇类更强,但比羧酸弱。苯酚在水中电离产生苯酚根离子(C?H?O?)和氢离子(H?),其电离常数(Ka)为1.3x10?1?。
酸性增强效应
与苯环相连的羟基官能团具有吸电子效应,会拉走苯环上的电子,使苯环上的其他碳原子电荷增加。这种效应会使苯环上的氢原子更容易解离,增强苯酚的酸性。
Ka值与温度
苯酚的Ka值会随着温度的变化而变化。一般来说,温度升高时,Ka值会减小,即苯酚的酸性会减弱。这是因为温度升高会促进苯酚根离子的解离,导致苯酚电离程度降低。
结论
苯酚的Ka值为1.3x10?1?,表明它是一种弱酸。苯环上的羟基官能团增强了苯酚的酸性。苯酚的Ka值会受温度的影响,温度升高时,Ka值会减小。
关键词:苯酚、酸性、电离常数、Ka值、芳香化合物
